COD là gì? Cụm từ viết tắt của Chemical Oxygen Demand nghĩa là nhu cầu oxy hóa học. Nhu cầu oxy hóa học là lượng oxy cần thiết để oxy hóa hoàn toàn carbon hữu cơ thành CO2 và nước.
Trong hóa học môi trường, nhu cầu oxy hóa học COD là gì? Đây được xem là thước đo chỉ định lượng oxy có thể được tiêu thụ bởi các phản ứng trong dung dịch. Biểu thị bằng khối lượng oxy tiêu thụ trên thể tích dung dịch, đơn vị là miligam trên lít (mg/L).
Xét nghiệm COD sử dụng để dễ dàng định lượng chất hữu cơ trong nước. Ứng dụng phổ biến nhất của COD là định lượng chất ô nhiễm có thể oxy hóa trong nước mặt hoặc nước thải. COD rất hữu ích nhờ cung cấp số liệu xác định ảnh hưởng của nước thải đối với đối tượng tiếp nhận, giống như nhu cầu oxy sinh hóa BOD.
Ý nghĩa của COD là gì?
Theo Wikipedia, nhu cầu oxy hóa học là phương pháp thứ 2 để ước tính lượng oxy trong nước sau hoạt động của vi khuẩn. Mặc dù việc xét nghiệm BOD (nhu cầu oxy sinh học) được thực hiện bằng các quẩn thể vi sinh vật để nhân bản số lượng tự nhiên trong một khoảng thời gian nhất định. Thì COD sử dụng chất oxy hóa mạnh như Kali dicromat hoặc Kali permanganate để oxy hóa các chất hữu cơ trong mẫu nước thải ở điều kiện nhiệt độ và axit mạnh.
Thử nghiệm COD có ưu điểm là không bị nhiễu từ các vật liệu độc hại. Thời gian hoàn thành chỉ cần 2 đến 3 giờ. Trái với BOD cần thời gian từ 5 đến 7 ngày.
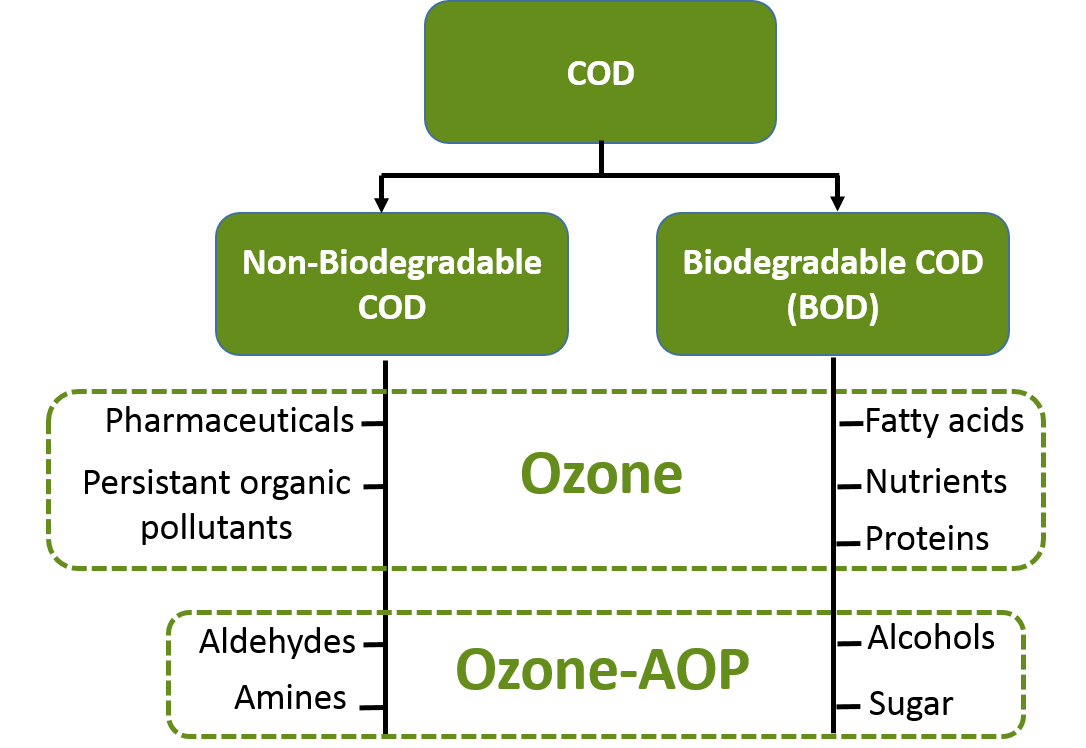
Thử nghiệm COD là hoàn toàn nhân tạo. Tuy nhiên, vẫn mang lại một kết quả có thể sử dụng làm cơ sở ước tính chính xác và tái sản xuất hợp lý các tính chất cần oxy của nước thải. Thử nghiệm COD thường được sử dụng cùng thử nghiệm BOD để ước tính vật liệu hữu cơ không phân hủy sinh học trong nước thải. Trong trường hợp các chất hữu cơ có thể phân hủy sinh học, COD thường ở khoảng 1.3 – 1.5 lần BOD.
Nếu kết quả COD cao gấp đôi so với BOD, có thể 1 phần đáng kể các chất hữu cơ trong mẫu nước không bị phân hủy bởi các vi sinh vật thông thường. Một lưu ý nhỏ nữa, kết quả sau thử nghiệm COD thu được thủy ngân vượt mức giới hạn quy định thì mẫu nước này cần phải bảo quản như loại chất thải nguy hại.
Tổng quan về COD
Cơ sở thử nghiệm COD gần như là tất cả các hợp chất hữu cơ có thể oxy hóa hoàn toàn thành Carbon dioxide với tác nhân oxy hóa mạnh trong điều kiện axit. Lượng oxy cần thiết để oxy hóa hợp chất hữu cơ thành Carbon dioxide, amoniac và nước như sau:
được đưa ra bởi:
CnHaObNc + (n + – – c) O2 à nCO2 + ( – c) H2O + cNH3
Phương trình này không bao gồm nhu cầu oxy do quá trình nitrat hóa. Quá trình oxy hóa ammoniac thành nitrat:
NH3 + 2O2 à NO3– + H3O–
Dicromat, tác nhân oxy hóa để xác định COD không oxy hóa ammoniac thành nitrat. Do đó, quá trình nitrat hóa không được đưa vào xét nghiệm COD tiêu chuẩn.
Sử dụng Kali dicromat
Kali dicromat là tác nhân oxy hóa mạnh trong điều kiện axit. Độ axit thường đạt được bằng cách thêm axit sulfuric. Phản ứng của Kali dicromat và các hợp chất hữu cơ nhu sau:
CnHaObNc = dCr2O72- + (8d + c) H+ à H2O + cNH4+ + 2dCr3+
d = + – –
Thông thường, dung dịch Kali dicromat 0.25 N được sử dụng để xác định COD. Mặc dù đối với các mẫu có COD dưới 50 mg/L nồng độ Kali dicromat thấp hơn được ưu tiến. trong quá trình oxy hóa các chất hữu cơ trong nước, Kali dicromat bị khử. Vì trong tất cả các phản ứng oxy hóa khử, thuốc thử bị oxy hóa và chất còn lại bị khử. Tạo thành Cr3+. Lượng Cr3+ được xác định sau quá trình oxy hóa hoàn tất và được sử dụng như một phép đo gián tiếp về hàm lượng hữu cơ của mẫu nước.
Đo lường lượng dư thừa
Tất cả các chất hữ cơ bị oxy hóa hoàn toàn cần 1 lượng Kali dicromat hoặc bất kỳ tác nhân oxy hóa nào bắt buộc phải có. Sau khi quá trình oxy hóa hoàn tất, phải đo lường lượng Kali dicromat dư thừa để đảm bảo xác định lượng Cr3+ chính xác.
Để làm được như vậy, Kali dicromat dư được chuẩn hóa nồng độ bằng sắt ammonium sulfate FAS cho đến khi tất cả các chất oxy hóa dư đã được giảm xuống Cr3+.
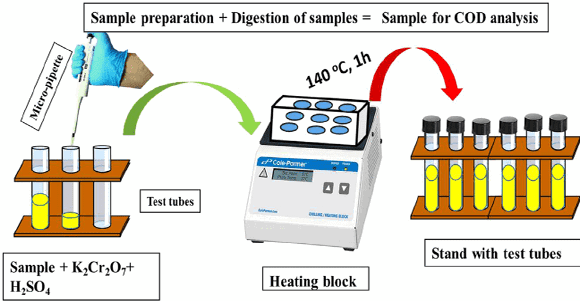
Thông thường, ferroin chỉ thị oxy hóa khử cũng được thêm vào trong bước chuẩn hóa nồng độ này. Khi tất cả các dicromat dư thừa được giảm, chỉ thị ferroin chuyển màu từ xanh lam sang nâu đỏ. Lượng ammonium sulfate thêm vào tương đương với lượng Kali dicromat dư ở mẫu ban đầu.
Lưu ý: Chất chỉ thị ferroin có màu đỏ tươi nhưng khi thêm vào mẫu có chứa Kali dicromat nó sẽ chuyển màu xanh lục.
Trong quá trình chuẩn hóa nồng độ, màu chất chỉ thị chuyển từ xanh lục sang màu xanh lam sáng. Cuối cùng mới chuyển thành màu nâu đỏ. Chất chỉ thị ferroin chuyển từ màu nâu đỏ sang xanh nhạt khi bị oxy hóa.
Chuẩn bị chất chỉ thị Ferroin
Chuẩn bị dung dịch 1.485g 1.10-phenanthroline monohydrate thêm vào dung dịch 695mg FeSO4.7H2O trong nước cất. Dung dịch màu đỏ thu được pha loãng thành 100ml.
Tính toán:
Tính COD bằng công thức: COD =
Trong đó, b là thể tích FAS được sử dụng trong mẫu trống. s là thể tích FAS ở mẫu ban đầu và n là quy tắc của FAS. Nếu mm được sử dụng nhất quán để đo thể tích thì kết quả tính toán COD được tính theo mg/L.
COD cũng được ước tính từ nồng độ của hợp chất oxy hóa trong mẫu, dựa trên phản ứng cân bằng hóa học với oxy để tạo ra CO2 (giả sử tất cả canxi đi vào CO2), H2O với tất cả H hợp thành H2O và NH3 với tất cả N chuyển sang NH3. Công thức như sau:
COD = (C/FW) . ( RMO).32
Có:
C = Nồng độ hợp chất oxy hóa trong mẫu.
FW = Trọng lượng công thức của hợp chất oxy hóa trong mẫu.
RMO = Tỷ lệ số mol của oxy với số mol hợp chất oxy hóa trong phản ứng với CO2, nước và ammoniac.
Ví dụ: C6H5OH + 7O2 à 6CO2 + 3H2O
COD = (500/94).7.32 = 1191 Wppm.
Nhiễu vô cơ
Một số mẫu nước chứa hàm lượng chất vô cơ oxy hóa cao có thể gây trở ngại cho việc xác định COD. Do nồng độ trong hầu hết nước thải cao, clorua thường là nguồn gây nhiễu nghiêm trọng nhất. Phản ứng với Kali dicromat như sau:
6Cl– + Cr2O72- + 14H+ à 3Cl2 + 2Cr3+ + 7H2O
Trước khi trâm các loại thuốc thử khác, sulfat thủy ngân nên trâm vào trước để khử nhiễu clorua.
Một số chất vô cơ gây nhiễu khác như: Nitrite, sắt, sulfua. Nitrite có thể sử dụng axit sulfamic để khử nhiễu. Sản phẩm thu được sẽ là khí N2.
Kết luận về khái niệm và ý nghĩa COD là gì?
Trong nhiều năm, tác nhân oxy hóa mạnh Kali permanganat KMnO4 đã được sử dụng để đo nhu cầu oxy hóa học COD. Các phép đo được gọi là oxy tiêu thụ từ permanganate chứ không phải nhu cầu oxy của các chất hữu cơ. Hiệu quả của Kali permanganate trong quá trình oxy hóa các hợp chất hữu cơ khác nhau.
Trong nhiều trường hợp, các phép đo nhu cầu oxy sinh hóa BOD lớn hơn nhiều so với COD. Điều này chỉ ra rằng Kali permanganate không thể oxy hóa hiệu quả tất cả các hợp chất hữu cơ trong nước. Khiến nó trở thành tác nhân oxy hóa tương đối kém để xác định COD.

Các chất oxy hóa khác như Ceric sulphate, Kali iodate và Kali dicromat đã được sử dụng để xác định COD thay thế. Trong đó, Kali Dicromat K2Cr2O7 được chứng minh là hiệu quả nhất. Nhờ tính tương đối rẻ, dễ tinh chế và có khả năng oxy hóa gần như hoàn toàn các hợp chất hữu cơ.
Trong các phương pháp này, thể tích cố định với lượng chất oxy hóa vượt quá có đo lường được thêm vào mẫu dung dịch được phân tích. Sau khi phân hủy hồi lưu, nồng độ ban đầu của các chất hữu cơ trong mẫu được tính bằng phép chuẩn hóa nồng độ hoặc đo quang phổ của chất oxy hóa vẫn còn trong mẫu.
Bài viết COD là gì của đội ngũ kỹ thuật viên Nihophawa hi vọng đã giải đáp thắc mắc của các bạn về COD. Một chỉ số cực kỳ quan trọng trong quá trình phân tích và xử lý nước thải. Nếu có nhu cầu lắp đặt và thi công hệ thống xử lý nước thải y tế. Quý khách có thể để lại số điện thoại, Nihophawa sẽ trực tiếp tư vấn.